Werner-Komplex
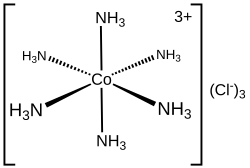
Werner-Komplexe sind Koordinationsverbindungen mit einem Übergangsmetallion als Zentralatom und Liganden wie Ammoniak, Wasser oder Halogenidionen, die über ihre freien Elektronenpaare an die Metalle binden. Sie bilden die klassische Form von Komplexen, die auf Alfred Werners bahnbrechender Theorie aus dem Jahr 1893 basieren. Sein Konzept bildet die Grundlage der Koordinationschemie, auf der ein großes Teilgebiet der Anorganischen Chemie aufgebaut ist. Werner standen zunächst keine Methoden zur Verfügung, die eine direkte Strukturaufklärung ermöglicht hätten. Die Bestimmung der Komplexkonfiguration gelang ihm mithilfe einfacher, indirekter Methoden wie der Bestimmung der Anzahl der Isomere, der Kryoskopie und der Leitfähigkeitsmessung.
Die Bildung der Werner-Komplexe kann mit dem Lewis-Säure-Base-Konzept beschrieben werden. Dabei reagiert ein Metallion, das zu den Lewis-Säuren zählt, wie etwa Co3+, mit einem zu den Lewis-Basen zählenden Molekül oder Ion mit mindestens einem freien Elektronenpaar zu einem Komplex. Werner wurde „in Anerkennung seiner Arbeiten über die Verknüpfung von Atomen in Molekülen, durch die er ein neues Licht auf frühere Untersuchungen geworfen und neue Forschungsgebiete, insbesondere in der anorganischen Chemie, erschlossen hat“ im Jahr 1913 mit dem Nobelpreis für Chemie ausgezeichnet.
Nomenklatur
Das erste Nomenklatursystem der Komplexe basierte auf deren Farbe und wurde von Edmond Frémy in der zweiten Hälfte des 19. Jahrhunderts eingeführt.
| Komplex | Präfix | Farbe |
|---|---|---|
| [Co(NH3)6]3+ | Luteo | goldbraun |
| [Co(NH3)5Cl]2+ | Purpureo | purpur |
| trans-[Co(NH3)4Cl2]+ | Praseo | grün |
| cis-[Co(NH3)4Cl2]+ | Violeo | violett |
| [Co(NH3)5(NO2)]2+ | Xantho | orange |
Der goldbraune Hexammin-Komplex [Co(NH3)6]Cl3 wurde als Luteocobaltchlorid bezeichnet. Analog wurden die Hexamminkomplexe anderer Übergangsmetalle ebenfalls als Luteo-Salze bezeichnet.
Geschichte
-
 Alfred Werner
Alfred Werner
(um 1913) -
 Sophus Mads Jørgensen (um 1900)
Sophus Mads Jørgensen (um 1900)
Nach Werners eigener Aussage kam ihm im Spätherbst 1892 gegen zwei Uhr nachts eine Idee, die eine damals völlig neue Vorstellung vom räumlichen Aufbau anorganischer Komplexverbindungen darstellte und später die moderne Komplexchemie begründen sollte. Bis zum folgenden Nachmittag schrieb er seine Gedanken in einem Aufsatz nieder, den er im Dezember 1892 unter dem Titel „Beiträge zur Konstitution anorganischer Verbindungen“ bei der Zeitschrift für Anorganische Chemie einreichte. Seine Theorie beruhte auf rein theoretischen Überlegungen. Bis dahin hatte er noch kein einziges Experiment zu diesem Thema durchgeführt, was einen Kollegen dazu brachte, sein Konzept als „geniale Frechheit“ zu bezeichnen.[2]
Da sich die Strukturen der organischen Verbindungen leicht mit den Grundsätzen der chemischen Valenz erklären ließen, wurde zunächst versucht, dieses Modell auch auf die anorganischen Verbindungen anzuwenden. Während dies bei einfachen Salzen gelang, war das Aufstellen von Strukturformeln bei den komplexen Salzen, den sogenannten „Molekülverbindungen“ wie Amminkomplexen oder Hydraten, meistens problematisch.[3]
Die Amminkomplexe waren von entscheidender Bedeutung für die Entwicklung der Koordinationschemie, insbesondere für die Bestimmung der Stereochemie. Die Darstellung der Komplexe ist einfach und das Metall-Stickstoff-Verhältnis kann durch Elementaranalyse bestimmt werden. Die systematische Erforschung der Komplexe begann 1878 durch Sophus Mads Jørgensen. Er synthetisierte eine Vielzahl von Komplexverbindungen von Cobalt, Chrom, Rhodium und Platin und schuf damit die Grundlage für die Koordinationstheorie von Alfred Werner. Werner und Jørgensen vertraten lange Zeit unterschiedliche Ansichten über die Struktur der Komplexe.[4]
Bis zu Werners Arbeiten wurde angenommen, dass die Liganden wie Ammoniak und Chloridionen Ketten bilden, die kovalent an das Metall gebunden sind. Die Kettenstruktur erklärte jedoch viele Eigenschaften der Komplexe nicht, beispielsweise warum in manchen Komplexen Chloridionen mit Silbernitrat gefällt werden konnten, in anderen jedoch nicht.
Werner stellte die Theorie auf, dass es zwei Bindungssphären um das Zentralatom gibt. In der inneren Sphäre, dem eigentlichen Komplex, sind die Moleküle oder Ionen koordinativ gebunden. Die äußere Sphäre enthält elektrisch geladene Ionen, die ionisch gebunden sind oder Moleküle wie als Kristallwasser gebundenes Wasser.[3] Werners Theorie erklärte unter anderem die Anzahl der möglichen Isomere in einem oktaedrisch koordinierten Komplex auf einfache Weise. Die stereochemischen Argumente waren zwar überzeugend, stellten jedoch lediglich einen indirekten Beweis für Werners Theorie dar.
Werners Ideen betrafen jedoch nicht nur die oktaedrische Koordination der Cobaltkomplexe. Er schlug auch die quadratisch-planare Struktur von Verbindungen des Typs M-A2B2 vor, die alle sich daraus ergebenden Möglichkeiten zur Bildung von Isomeren erklärte. Im Gegensatz zu Jørgensen ging Werner davon aus, dass die vier Liganden direkt an das Metall gebunden und quadratisch-planar angeordnet sind und die Isomerie auf die cis- und trans-Position der Ammoniak- und Chlorid-Liganden zurückzuführen ist. Dies erklärte, warum etwa die Reaktion des Tetramminkomplexes des Platins mit Pyridin (als py abgekürzt) zu zwei Isomeren der Zusammensetzung [Pt(NH3)2(py)2]Cl2 mit Ammoniak- und Pyridin-Liganden in cis- und trans-Stellung führte.[5]

- Strukturvorschläge von Jørgensen (links) und Werner (rechts)
für das cis-Isomer des Dichloridsalzes des Komplexes [Pt(NH3)2(py)2]2+
Ein weiterer Erfolg war die einfache Erklärung der Leitfähigkeit von Ammincobaltkomplexen. Für die Komplexe [Co(NH3)3]Cl3, [Co(NH3)5Cl]Cl2 und [Co(NH3)4Cl2]Cl entsprach die gemessene Leitfähigkeit Salzen, die in vier, drei beziehungsweise zwei Ionen dissoziieren. Diese Ergebnisse konnten sowohl nach Werners als auch nach Jørgensens Theorie erklärt werden. Dass der Komplex [Co(NH3)3Cl3] jedoch keine Leitfähigkeit aufwies, erklärte nur Werners Theorie.[2] Später wurden die Strukturvorschläge von Werner durch Röntgenstrukturanalyse und andere Methoden zur Aufklärung der chemischen Struktur bestätigt, darunter etwa die oktaedrische Anordnung der Ammoniakliganden im Hexammincobalt(III)-iodid ([Co(NH3)6]I3).[6]
Stereochemie
Konstitutionsisomerie
Werner schlug 1893 die korrekten Strukturen für diese Komplexe vor, in denen ein zentrales Übergangsmetallatom oder -ion von neutralen oder anionischen Liganden umgeben ist. Die Konstitutionsisomerie der Cobaltamminkomplexe zeigte sich darin, dass ionisch gebundene Anionen in die innere Sphäre des Komplexes wechselten und dort einen Ammoniakliganden verdrängten. Bekannt waren zum Beispiel die Komplexe [Co(NH3)6]Cl3 („Luteocobaltchlorid“), [Co(NH3)5Cl]Cl2 („Purpureocobaltchlorid“), trans-[Co(NH3)4Cl2]Cl („Praseocobaltchlorid“), cis-[Co(NH3)4Cl2]Cl („Violeocobaltchlorid“), [Co(NH3)3(NO2)3] („Hexamincobaltnitrit“) und K[Co(NH3)2(NO2)4] („Erdmannsches Salz“).[7] Diese Art der Konstitutionsisomerie wird auch als Ionisationsisomerie bezeichnet.[8]
Hydratisomerie
Hydratisomerie ist eine spezielle Form der Konstitutionsisomerie. Am Beispiel der verschiedenen Aquakomplexe des Chrom(III)-chlorids konnte Werner zeigen, dass es sich dabei um Hydratisomere handelt. Beim blauen Hexaquochromchloridkomplex ([Cr(OH2)6]Cl3) sind alle Wassermoleküle direkt am Chrom gebunden, während das grüne Dichlorotetraaquachrom(III)-chlorid der Konstitutionsformel [Cr(OH2)4Cl2] Cl + 2 H2O entspricht, wobei 2 Moleküle Wasser als Kristallwasser vorliegen.[9]
Koordinationsisomerie
Ein weiteres Phänomen, das Werners Theorie auf einfache Weise erklären konnte, war das Auftreten komplexer Salze, bei denen die gleichen Arten von Atomen in gleicher Anzahl vorkommen, deren Zentralatome von Kation und Anion jedoch vertauscht sind. Ein Beispiel dafür waren die Salze Tetramminkupfertetrachloroplatinat ([Cu(NH3)4] [PtCl4]) und Tetramminplatintetrachlorocuprat ([Pt(NH3)4] [CuCl4]). Diese Art der Isomerie wird als Koordinationsisomerie bezeichnet.[10]
cis/trans-Isomerie
Das Modell erklärte auf einfache Weise auch das Auftreten von zwei Isomeren beim Komplex Tetrammindichlorocobalt(III)-Kation, [Co(NH3)4Cl2]+. Bei diesem Komplextyp der allgemeinen Form M-A4X2 kann eine cis- und eine trans-Form auftreten.[11]
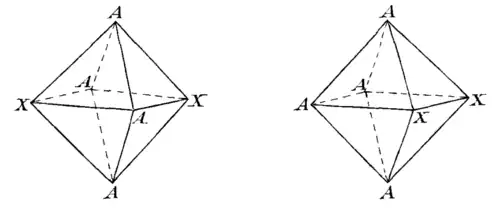
- Isomere eines oktaedrischen Komplexes der Form M-A4X2[12]
Bei einer planaren sechseckigen Anordnung wie etwa im Benzol müssten die drei orto-, meta- und para-substituierte Isomere auftreten.
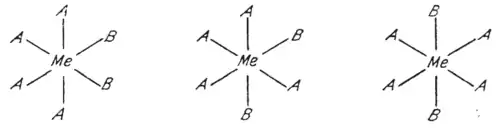
- Isomere eines planar sechseckigen Komplexes
Ebenso würden bei einer prismatischen Anordnung der Liganden um das Zentraltom drei Isomere auftreten.
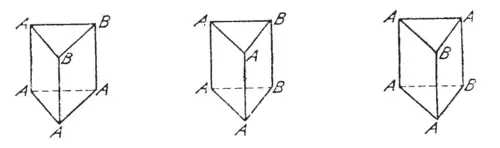
- Isomere eines prismatisch koordinierten Komplexes
Jedoch konnten bei keinem Komplex der Form M-A4X2 mehr als zwei Isomere nachgewiesen werden.[9]
Auch die Bestimmung der Konfiguration der Tetrammincobaltkomplexe des Typs [Co(NH3)4X2] gelang Werner mit dem Modell des oktaedrisch koordinierten Komplexes. Er konnte zeigen, dass Verbindungen, die statt zwei einzähnigen Liganden X einen zweizähnigen Liganden besaßen, der zwei Koordinationsstellen nur in cis-Stellung komplexieren konnte wie beispielsweise Carbonat- oder Sulfit-Gruppen, beim Ersatz durch Chlorid- oder Bromidionen stets die violette Farbe der cis-Verbindungen ergaben, obwohl unter den Reaktionsbedingungen eigentlich die stabileren, grünen trans-Verbindungen entstehen sollten.[9]
Spiegelbildisomerie
Der endgültige Beweis der stereochemischen Vorstellungen Werners gelang durch die Synthese und anschließender Racematspaltung von optisch aktiven Metallkomplexen. Mithilfe von Chelatliganden wie Ethylendiamin (abgekürzt als en) war es möglich, chirale Verbindungen darzustellen. Die Racematspaltung von [Co(en)2(NH3)Cl]Cl2 in seine Enantiomere, gelang ihm 1911 mit Hilfe von (+)- Bromcamphersulfonat.[2]
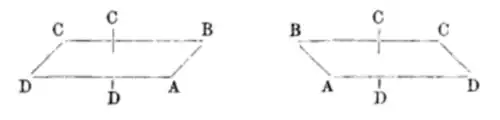
- Enantiomere chiraler, oktaedrisch koordinierter Komplexe
Die Gegner der Wernerschen Theorie behaupteten jedoch, dass die Chiralität des Komplexes von den verwendeten kohlenstoffhaltigen Liganden käme. Werner gelang der Nachweis, dass Hexol, ein Koordinationskomplex, der aus vier Cobaltkationen in der Oxidationsstufe +3, zwölf Ammoniakmolekülen NH3 und sechs Hydroxidionen HO- mit einer Nettoladung von +6 besteht ({[Co(NH3)4(OH)2]3Co}6+), in zwei optischen Isomeren vorkommt, die spiegelbildlich zueinander sind. Die Racematspaltung gelang wiederum mit Hilfe von (+)-Bromcamphersulfonat.[13]
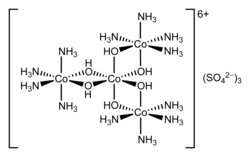
- Struktur von Hexolsulfat
Hexol gilt als die erste synthetische, nicht kohlenstoffhaltige chirale Verbindung. Die Salze des Hexols wurden erstmals von Jørgensen beschrieben, aber erst Werner erkannte seine richtige Struktur.[14]
Leitfähigkeit
Durch die Messung der molekularen Leitfähigkeiten verschiedener Cobalt-, Chrom- und Platin-Amminkomplexe konnte Werner zeigen, dass diese in Übereinstimmung mit seiner Koordinationstheorie standen.[7] Die Messung der molekularen Leitfähigkeit einer Reihe von Amminplatin(IV)-Komplexen vom Hexamminplatinchlorid zu Kaliumhexachloroplatinat ergab beispielsweise, dass die Leitfähigkeit bei zunehmendem Ersatz von Ammoniak durch Chloridionen in der inneren Sphäre zunächst auf Null abfällt, da beim Komplex Tetrachlordiamminplatin [Pt(NH3)2Cl4] kein Chloridion mehr ionisch gebunden ist.
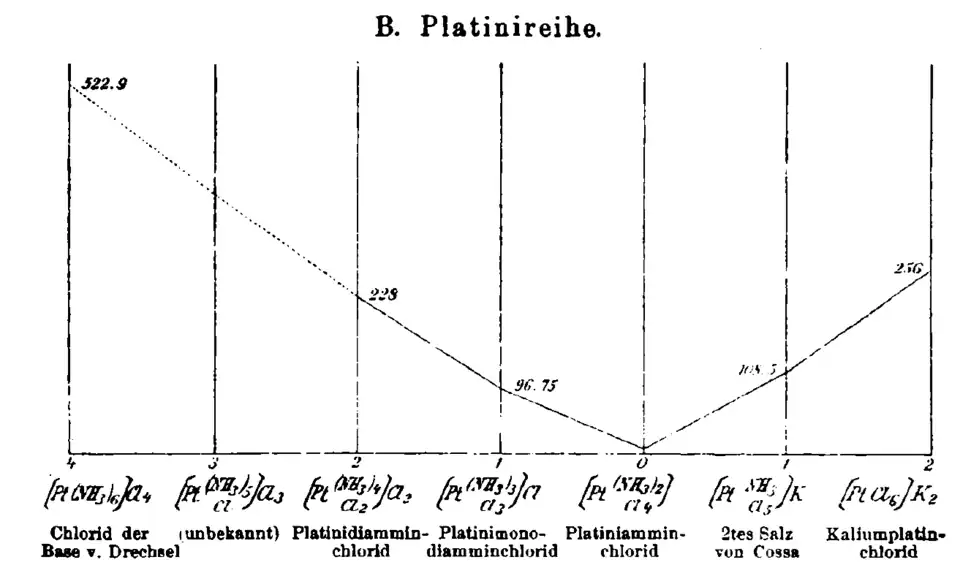
- Molare Leitfähigkeit Λm (in Ω−1cm2mol−1) von Platin(IV)-Komplexen in wässriger Lösung[7]
Bei den nachfolgenden Gliedern der Reihe, die Penta- und Hexachloroplatinatanionen enthalten, steigt die Leitfähigkeit wieder an. Zudem zeigen die jeweils in drei Ionen dissoziierten Komplexe [Pt(NH3)4Cl2]CI2 und K2[PtCl6] in etwa die gleiche Leitfähigkeit.[15]
Die Ergebnisse der Leitfähigkeitsmessung konnten sowohl durch kryoskopische Untersuchungen der wässerigen Lösungen als auch durch die Fällung der ionisch gebundenen Chloride durch Silbernitrat bestätigt werden.[16]
Weblinks
Literatur
- Alfred Werner: Über die Konstitution und Konfiguration von Verbindungen höherer Ordnung, Nobelvortrag, 11. Dezember 1913, (PDF-Datei) auf libarch.nmu.org.ua, doi:10.1007/978-3-642-98956-8.
- Lutz H. Gade: Alfred Werners Koordinationstheorie: „Eine geniale Frechheit”. In: Chemie in unserer Zeit. 36.3, 2002, S. 168–175, doi:10.1002/1521-3781(200206)36:3<168::aid-ciuz168>3.0.co;2-3.
- Lutz H. Gade: Koordinationschemie, Wiley-VCH 1998, Kapitel I.2.1, ISBN 978-3-527-29503-6.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, Kapitel XX: Grundlagen der Komplexchemie, S. 1315–1400.
Einzelnachweise
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1316.
- ↑ a b c L. H. Gade: Alfred Werners Koordinationstheorie: „Eine geniale Frechheit”. In: Chemie in unserer Zeit. 36.3, 2002, S. 168–175, doi:10.1002/1521-3781(200206)36:3<168::aid-ciuz168>3.0.co;2-3.
- ↑ a b E. Rey: Alfred Werner, Begründer der Koordinationslehre. In: Chimia. 20.12, 1966, S. 411–419, doi:10.2533/chimia.1966.411.
- ↑ Lutz H. Gade: Koordinationschemie, Wiley-VCH 1998, ISBN 978-3-527-29503-6, S. 5–6.
- ↑ H. Werner: Alfred Werner: A Forerunner to Modern Inorganic Chemistry. In: Angewandte Chemie International Edition. 52.24, 2013, S. 6146–6153, doi:10.1002/anie.201208389.
- ↑ R. W. G. Wyckoff, T. P. McCutcheon: The crystal structure of hexamine cobalt iodide [Co(NH3)6]I3. In: American Journal of Science. 1927, s5-13(75), S. 223–233, doi:10.2475/ajs.s5-13.75.223.
- ↑ a b c Alfred Werner, A. Miolati: Beiträge zur Konstitution anorganischer Verbindungen. In: Zeitschrift für Physikalische Chemie. 14U.1, 1894, S. 506–521, doi:10.1515/zpch-1894-1438.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1343.
- ↑ a b c Alfred Werner: Über die Konstitution und Konfiguration von Verbindungen höherer Ordnung, Nobelvortrag, 11. Dezember 1913, (PDF-Datei) auf libarch.nmu.org.ua, doi:10.1007/978-3-642-98956-8.
- ↑ U. Wannagat: Das Porträt: Alfred Werner. In: Chemie in unserer Zeit. 1.1, 1967, S. 24–27, doi:10.1002/ciuz.19670010106.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1344–1354.
- ↑ Alfred Werner: Beitrag zur Konstitution anorganischer Verbindungen. Die Kobaltammoniakverbindungen und ihre Nomenklatur. In: Zeitschrift für anorganische Chemie. 14.1, 1897, S. 21–27, doi:10.1002/zaac.18970140103.
- ↑ Alfred Werner: Über mehrkernige Metallammoniake. In: Berichte der Deutschen Chemischen Gesellschaft. 40.2, 1907, S. 2103–2125, doi:10.1002/cber.190704002126.
- ↑ K. Ernst, H. Berke: Optical activity and Alfred Werner’s coordination chemistry. In: Chirality. 23.3, 2010, S. 187–189, doi:10.1002/chir.20912.
- ↑ E. Uhlig: Elektrochemische Methoden in der Koordinations- und Elementorganochemie. In: Zeitschrift für Physikalische Chemie. 269.2, 1988, S. 364–372, doi:10.1515/zpch-1988-26940.
- ↑ Alfred Werner: Beitrag zur Konstitution anorganischer Verbindungen. XX. Mitteilung. Über rhodanatokobaltiake und strukturisomere Salze. In: Zeitschrift für anorganische Chemie. 22.1, 1899, S. 91-157, doi: 10.1002/zaac.18990220104.