Silylenolether
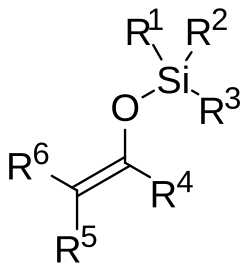
Silylenolether sind eine Stoffgruppe der organischen Chemie. Es handelt sich um Enolether, bei denen an das Sauerstoffatom eine Silylgruppe gebunden ist. Die Silylenolether haben erhebliche Bedeutung in der organischen Synthese, vor allem für die Knüpfung von Kohlenstoff-Kohlenstoff-Bindungen.
Herstellung
Silylenolether werden durch Umsetzung eines Lithiumenolats oder einer Carbonylverbindung (in Gegenwart einer Base) mit einer elektrophilen Silylverbindung hergestellt. Das wichtigste Reagenz hierfür ist Trimethylsilylchlorid. Silylverbindungen reagieren grundsätzlich mit dem Sauerstoffatom, einerseits weil es sich um ein hartes Elektrophil handelt, andererseits wegen der hohen Bindungsstärke der Si-O-Bindung.[1]
Diverse Methoden für die Herstellung von Silylenolethern aus Ketonen sind bekannt und viele funktionieren auch mit Aldehyden. Beispiele für Reagenzienkombinationen sind Trimethylsilyltriflat mit Triethylamin; Trimethylsilylchlorid mit Triethylamin und Natriumiodid oder Lithiumsulfid; Trimethylsilylchlorid mit Hünig-Base, Diazabicycloundecen, Natriumhydrid oder Kaliumhydrid; sowie Bis(trimethylsilyl)acetamid.[2]
Reaktionen
Silylenolether sind leicht herzustellen und leicht wieder zu desilylieren und weisen eine relativ hohe Reaktivität bei gleichzeitig sehr guter Selektivität vieler Reaktionen auf, was sie zu einer der wichtigsten Gruppen der Enol- beziehungsweise Enolat-ähnlichen Verbindungen macht.[2]
Der wichtigste Verwendungsbereich der Silylenolether ist die Knüpfung von C-C-Bindungen. Die direkte Alkylierung funktioniert mit Halogeniden und Acetaten von tertiären, benzylischen und allylischen Gruppen, wobei meist eine Lewis-Säure wie Titan(IV)-chlorid, Zinkchlorid oder Zinkiodid eingesetzt werden muss. Beispiele für geeignete Alkylierungsmittel sind tert-Butylchlorid, tert-Butylacetat, 1-Bromadamantan, Benzylbromid, Prenylbromid und Prenylchlorid. Die Acylierung gelingt mit Carbonsäurechloriden und Acyliumtetrafluoroboraten in Gegenwart von Titan(IV)-chlorid. Durch Reaktion mit Methyllithium werden aus Silylenolethern Lithiumenolate erhalten, die mit weniger reaktiven Elektrophilen reagieren.[2]
Durch Reaktion eines Silylenolethers mit einem Acetal entsteht ein Kupplungsprodukt mit einer β-Alkoxygruppe. Eine wichtige Reaktion der Silylenolether ist die Aldolkondensation, die im Gegensatz zu deren traditioneller Variante sehr selektiv ist. Silylenolether reagieren außerdem gut mit Michaelakzeptoren wie Vinylketonen und Nitroalkenen. Die Reaktion mit einem Grignard-Reagenz in Gegenwart eines Nickel-Komplexes wie Nickel(II)-acetylacetonat ermöglicht eine nukleophile Substitution der Siloxygruppe zur Herstellung hochsubstituierter Alkene. Silylenolether reagieren in diversen Cycloadditionen. Ein wichtiges Beispiel ist die Simmons-Smith-Reaktion zur Herstellung von Cyclopropanen. Auch einige Diels-Alder-Reaktionen mit Silylenolethern als Dienophile oder Cycloadditionen von Nitriloxiden an Silylenolether sind bekannt.[2] Wichtiger sind Silylenolether als Dien-Komponenten in Diels-Alder-Reaktionen. Ein Beispiel für eine solche Verbindung ist das 2-Trimethylsilyloxybutadien.[3]
Einige Silylenolether wie Trimethylsilylacetylaceton eignen sich als Reagenzien für die Silylierung von Alkoholen. Silylenolether gehen diverse Oxidationsreaktionen ein. Dazu gehören die Hydroborierung/Oxidation zu Glycolen, die Reaktion mit Singulett-Sauerstoff zu Ketonen mit α-Hydroperoxygruppe und mit meta-Chlorperbenzoesäure zu Hydroxyketonen.[2] Die Oxidation mit Blei(IV)-carboxylaten wie Blei(IV)-acetat ergibt Ketone mit α-Acyloxygruppe.[2][4] Auch eine Ozonolyse von Silylenolethern ist möglich. Letztere wurde zum Beispiel in einer Synthese des Pheromons Lineatin eingesetzt. Silylenolether können mit diversen Reagenzien halogeniert werden, um α-Halogenketone zu erhalten. Die Chlorierung ist mit Chlor oder N-Chlorsuccinimid möglich, die Bromierung mit Brom oder N-Bromsuccinimid, die Fluorierung mit Trifluormethylhypofluorit und die Iodierung mit Iod in Gegenwart von Silberacetat.[2]
Einzelnachweise
- ↑ Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry. OUP Oxford, 2012, ISBN 978-0-19-927029-3, S. 466 (google.de [abgerufen am 13. Mai 2025]).
- ↑ a b c d e f g Peter Brownbridge: Silyl Enol Ethers in Synthesis - Part I. In: Synthesis. Band 1983, Nr. 01, 1983, S. 1–28, doi:10.1055/s-1983-30204.
- ↑ Peter Brownbridge: Silyl Enol Ethers in Synthesis - Part II. In: Synthesis. Band 1983, Nr. 02, 1983, S. 85–104, doi:10.1055/s-1983-30234.
- ↑ George M. Rubottom, Roberto Marrero, John M. Gruber: The reaction of aldehyde enol silyl ethers with lead(IV) acetate. In: Tetrahedron. Band 39, Nr. 6, Januar 1983, S. 861–865, doi:10.1016/S0040-4020(01)88584-7.