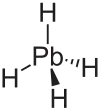
Plumban
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Plumban | ||||||||||||
| Andere Namen |
Bleiwasserstoff | ||||||||||||
| Summenformel | PbH4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 211,23 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Siedepunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Plumban, auch Bleiwasserstoff, ist ein sehr giftiges Gas. Es hat die Formel PbH4 und besitzt einen Siedepunkt von −13 °C.
Gewinnung und Darstellung
Plumban entsteht durch Einwirkung von kathodisch entwickeltem atomaren Wasserstoff auf zerstäubtes Blei.[4]
Es wird in Analogie zu Bismutan (BiH3) auch gebildet, wenn Dimethylplumban mit der Formel (CH3)2PbH2 oberhalb von −50 °C disproportioniert.[4]
Bei der Herstellung von Tetraethylblei entsteht Plumban in kleinen Mengen als Nebenprodukt.
Eigenschaften
Im Gegensatz zum analog aufgebauten Methan (CH4) ist Plumban chemisch instabil. Wenn man das Gas über eine erhitzte Oberfläche leitet, zerfällt es unter Abscheidung eines Bleispiegels. Der Grund dafür liegt darin, dass Blei als Metall elektropositiver als die gebundenen Wasserstoffatome ist, den Wasserstoff also als Hydrid bindet.
Beständiger als das Plumban sind Derivate mit organischen Substituenten, beispielsweise
- Tetramethylblei Pb(CH3)4 oder
- Tetraethylblei Pb(C2H5)4 (TEL).
Diese Stoffe wurden vor der Entwicklung des bleifreien Benzins als Antiklopfmittel eingesetzt. Da sie hautresorbierbar und giftig sind (MAK-Wert von TEL 0,075 mg/m3), hat man bleihaltiges Benzin seit 1998 in Deutschland, seit 2000 in der gesamten Europäischen Union verboten.
Literatur
- Xuefeng Wang, Lester Andrews: Infrared Spectra of Group 14 Hydrides in Solid Hydrogen: Experimental Observation of PbH4, Pb2H2, and Pb2H4; Journal of the American Chemical Society, 1. Mai 2003, doi:10.1021/ja029862l.
- Bole Chen, Lewis J. Conway, Weiguo Sun, Xiaoyu Kuang, Cheng Lu, and Andreas Hermann: Phase stability and superconductivity of lead hydrides at high pressure, 19. Januar 2021; doi:10.1103/PhysRevB.103.035131.
Einzelnachweise
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1011.
- ↑ Eintrag zu Bleiverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. April 2025. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag lead compounds with the exception of those specified elsewhere in this Annex in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. April 2025. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 57.–70. Auflage. Walter de Gruyter, Berlin 1964, S. 362.


