Antimon(III)-tellurid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Sb3+ _ Te2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Antimon(III)-tellurid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | Sb2Te3 | ||||||||||||||||||
| Kurzbeschreibung |
geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 626,30 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
6,50 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Antimon(III)-tellurid ist eine anorganische chemische Verbindung des Antimons aus der Gruppe der Telluride.
Gewinnung und Darstellung
Antimon(III)-tellurid kann durch Reaktion von Antimon mit Tellur gewonnen werden.
Sie kann auch aus Antimon(III)-oxid mit Tellur und Natriumformiat bei hohem Druck dargestellt werden.[4]
Eigenschaften
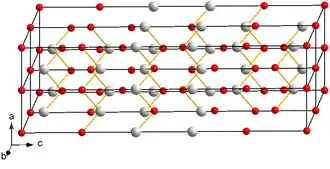
Antimon(III)-tellurid ist ein grauer geruchloser Feststoff.[1] Die Verbindung hat eine rhomboedrische Kristallstruktur mit der Raumgruppe R3m (Raumgruppen-Nr. 166). Eine hexagonale Zelle enthält 15 Atome gruppiert in drei Schichten.[5] Es existiert auch eine monokline Hochdruckmodifikation.[6]
Verwendung
Antimon(III)-tellurid ist zusammen mit Bismuttellurid und anderen strukturell analogen Halbleitern eines der besten Materialien für bei Raumtemperatur thermoelektrische Geräte. Es ist eine Schlüsselkomponente von thermoelektrischen Materialien die ZT-Werte von 2,4 bei Raumtemperatur erreichen könnten.[7]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Antimon(III)-tellurid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2020. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag antimony compounds, with the exception of the tetroxide (Sb2O4), pentoxide (Sb2O5), trisulphide (Sb2S3), pentasulphide (Sb2S5) and those specified elsewhere in this Annex in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Juni 2025. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ M. Binnewies, E. Milke: Thermochemical Data of Elements and Compounds. 2. Auflage. Wiley-VCH, weinheim 2002, ISBN 3-527-30524-6, S. 829.
- ↑ Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 3807 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ B. Yu. Yavorsky, N. F. Hinsche, I. Mertig, P. Zahn: Electronic structure and transport anisotropy of Bi2Te3 and Sb2Te3. In: Physical Review B. 84, 2011, doi:10.1103/PhysRevB.84.165208.
- ↑ S.M. Souza, C.M. Poffo, D.M. Trichês, J.C. de Lima, T.A. Grandi, A. Polian, M. Gauthier: High pressure monoclinic phases of Sb2Te3. In: Physica B: Condensed Matter. 407, 2012, S. 3781, doi:10.1016/j.physb.2012.05.061.
- ↑ R. Venkatasubramanian, E. Siivola, T. Colpitts & B. O’Quinn: Thin-film thermoelectric devices with high room-temperature figures of merit, In: Nature 413, 597-602, doi:10.1038/35098012

